Экологическая составляющая химического образования
Решение:
HgCl2 + Na2S = HgS¯ + 2NaCl
 с (HgCl2)
с (HgCl2)
5 · 10-3 г/л
![]() m (HgCl2) ® v(HgCl2)
m (HgCl2) ® v(HgCl2)
1500 г 5,52 моль
V0
300 · 10-3 л
по ур. реак.
m (Na2S) ® v (Na2S) ® v (HgCl2) ® vост(HgCl2) ® m (HgCl2)®с (HgCl2)
420 г 5,38 моль 5,38 моль 0,14 моль 39 г 0,127 мг/л
Ответ: с (HgCl2) = 0,127 мг/л, что значительно больше ПДК.
Задача 7. Выживут ли караси в озере объемом 500 000 м3, в воду которого попало 100м3 сточных вод сернокислотного завода, содержащих 1600 кг оксида серы(V1)? Токсическая концентрация серной кислоты для карасей равна 138 мг/л.
Решение:
m (SO3) ® v (SO3) ® v (Н2SO4) ® m (Н2SO4) ® с (Н2SO4)
1600 · 103 г 20 · 103 моль 20 · 103 моль 1960 · 103 г 3,92 мг/л
Ответ: c(H2SО4) = 3,92 мг/л, что значительно меньше токсической концентрации.
Задача 8. В результате вулканической деятельности образовалась смесь газов объемам 2000 м3 (н.у.), в которой объемная доля сероводорода составила 0,15. Сероводород полностью растворился в соседнем водоеме, объем воды в котором 5 · 10 м3. Можно ли использовать воду из данного источника в хозяйственно-питьевых целях, если ПДК(Н2S) = 0,05 мг/л?
Решение:
V0(смесь) ® V(H2S) ® v(H2S) V (H2O)
2000 м3 300 м3 (н.у.) 13,4 · 103 моль 5 · 109 л
® m (H2S) ® c (H2S)
455,4 · 103 г 91,1 · 10-6 г/л (0,091 мг/л)
Ответ: c (H2S) = 0,091 мг/л, т. е. больше ПДК. [10]
Задача 9. Концентрация ионов водорода в дождевых водах Нигерии во время грозы достигает 0,001 моль/л. Выполните следующие задания: 1) объясните появление ионов водорода в дождевой воде и напишите уравнения соответствующих реакций; 2) рассчитайте массу кислоты в дождевой воде массой 1 · 105 т (масса среднего грозового облака); 3) оцените массу углекислого газа, поступающую в атмосферу после выпадения таких осадков в районах, содержащих карбонатные породы.
Решение
1) при электрическом разряде (молнии) в воздухе образуются оксиды азота, которые в дальнейшем образуют азотную кислоту, эти процессы можно упрощенно записать в виде уравнений:
![]()
2NO + О2 ® 2NО2,
4NO2 + O2 + 2Н2О ® 4HNO3;
2) рассчитаем массу кислоты, образующейся при грозовых разрядах:
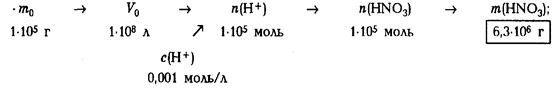
3) рассчитаем массу углекислого газа, образующегося при действии
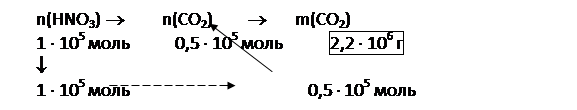 |
Ответ: 1) см. химические уравнения в п. 1 решения; 2) m(НNО3) = 6,3 т; 3) m(СО2) = 2,2 т.
Задача 10. В Центральной Европе и Северной Америке бывают дожди, в которых концентрация ионов водорода достигает 1-10~4 моль/л (рН ss 4). Оцените массы серной и азотной кислот в 1 т дождевой воды, исходя из следующих предположений: 1) кислую среду создает только серная кислота; 2) только азотная кислота; 3) смесь кислот в молярном отношении 1:1. Проанализируйте, какая дождевая вода (из указанных) опаснее для мраморных и известняковых сооружений?
Решение:
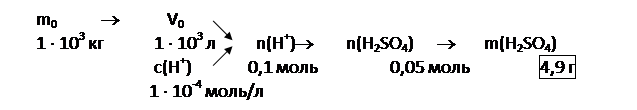 |
Образование, педагогика, воспитание:
Игровые технологии в младшем школьном возрасте
Игровые технологии применяются на уроках как в начальной школе, так и в среднем и старшем звене. Но в нашей работе мы рассмотрим подробно игровые технологии в младшем школьном возрасте. Для младшего школьного возраста характерны яркость и непосредственность восприятия, легкость вхождения в образы. ...
Учебные тренинговые игры на уроках истории России и исторического краеведения
Сегодня практически любой учитель истории применяет в своей деятельности нетрадиционные формы построения уроков. Это связано со становлением нового стиля педагогического мышления учителя, ориентирующегося на эффективное решение образовательно-воспитательных задач в условиях скромного количества пре ...
Понятие методов обучения
Метод (от гр. methodos – «исследование») – это прием, способ или образ действия; способ достижения цели, определенным образом упорядоченная деятельность; совокупность приемов или операций практического или теоретического освоения действительности, подчиненных решению конкретной задачи. В литературе ...
Навигация по сайту
- Активизация мышления
- Системы образования в разных странах мира
- Социальная адаптация ребенка
- Социальная работа в школе
- Физическое воспитание дошкольников
- Средства обучения математике
- Другое о педагогике

